Cette étude mycologique présente, dans un premier temps, l’inventaire des champignons effectué en 2017 sur une pelouse située dans le Coutançais. Vous y découvrirez de magnifiques espèces, rares et fragiles à la fois, ainsi que des champignons plus communs mais dont la présence est tout aussi importante pour caractériser et mieux comprendre le milieu dans lequel ils vivent. En effet, grâce aux travaux intergénérationnels des mycologues amateurs et professionnels, la mycologie devient de nos jours une science utile et nécessaire à la bonne compréhension des écosystèmes. Les connaissances accumulées sur les espèces bioindicatrices permettent de mieux cerner la rareté des milieux naturels et leurs évolutions dans le passé, le présent et le futur. Concernant les prairies et les pelouses, sujet de cette étude, un protocole mycologique permettant d’évaluer leur intérêt patrimonial a d’ailleurs été créé en 2015 par Yann Sellier, Daniel Sugny et Gilles Corriol : il s’agit du protocole ‘CHEGD’. Celui-ci vous est présenté plus en détails dans la seconde partie de cette étude et son application sur les inventaires effectués nous permettra de mieux connaître l’intérêt patrimonial de cette maginifique pelouse.
Contexte stationnel et historique
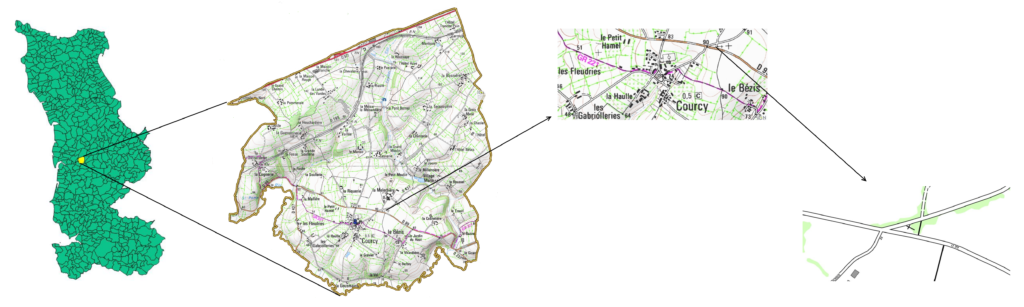
Situé sur la commune de Courcy, près de Coutances, le milieu étudié s’étend sur une superficie de 594 m2. Entièrement privé, il s’agit d’une pelouse délimitée sur toute sa périphérie par une petite charmille qui la sépare de deux routes et d’un chemin de terre. Quelques ifs se répartissent à l’est, sur un tiers de la surface du site, ils procurent de l’ombre et puisent une grande quantité d’eau et de nutriments dans le sol. Sous ces arbres, hormis une ou deux petites plantes vasculaires, on observe principalement des bryophytes. En revanche une plus grande diversité floristique est présente sur les deux tiers restants du site, là ou la pelouse s’expose sans protection face au soleil, à la pluie et au vent.
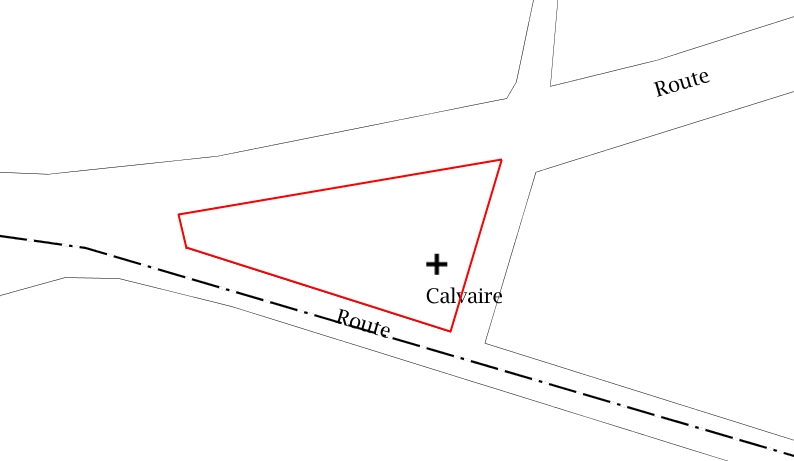
Pelouse de Courcy 
Pelouse de Courcy
La faune et la flore du site
La faune et à la flore sont ordinaires et typiques du bocage, voici un inventaire non-exhaustif :
Arbres et arbustes
Carpinus betulus : Charme
Taxus baccata : If commun
Plantes vasculaires
Achillea millefolium : Achillée millefeuille
Bellis perennis : Pâquerette
Hedera helix : Lierre grimpant
Hypochaeris radicata : Porcelle enracinée
Luzula campestris :Luzule des champs
Orchis mascula : Orchis mâle
Plantago lanceolata : Plantain lancéolé
Parmi les plantes on trouve aussi des bryophytes et parmi elles deux espèces sont abondantes et très intéressantes pour cette étude mycologique, il s’agit de :
Rhytidiadelphus squarrosus : Hypne squarreux &Pseudoscleropodium purum : Hypne pur
D’un point de vue mycologique, ces deux moussesseraient, selon Griffith et coll. (2013), très fréquemment présentes dans les « prairies à hygrocybes », ce que souligne aussi Arnolds (1981, 1982).
Faune
Outre le crache-sang Timarcha tenebricosa, peu d’espèces ont été identifiées jusqu’ici. Parmi les insectes, il pourrait être intéressant d’inventorier certains groupes tels que les diptère et les hyménoptères. De belles découvertes sont envisageables !
Matériels et méthodes d’inventaire
L’inventaire s’est déroulé au cours de l’automne et de l’hiver 2017-2018, trois visites ont été effectuées : le 26 octobre 2017, le 8 novembre 2017 et le 7 janvier 2018.
Bien que la superficie du site soit restreinte, une heure minimum de prospection active m’a tout de même été nécessaire à chaque visite afin de trouver, déterminer et photographier tout les champignons (sporophores). Quelques espèces ont aussi été soigneusement prélevées et conservées dans des récipients adéquats afin de confirmer leur identification au laboratoire.
De la découverte d’un champignon sur le terrain jusqu’à sa détermination sous le microscope, le matériel mis en oeuvre pour cette étude est conséquent. Il se compose dans un premier temps d’un couteau et d’une loupe de poche, de boîtes, d’un appareil photo réflex, d’un stéréo-microscope (10x à 40x), d’un microscope (40x à 1500x) avec objectif à immersion et occulaire gradué, d’une littérature spécialisée ainsi que de nombreux petits outils (pinces, scalpels, lames, etc.).
Liste systématique des taxons
| Noms scientifiques | Date des observations |
| Clavaria fumosa Pers. : Fr. | 26/10/17 & 08/11/17 |
| Clavulinopsis corniculata (J.C. Sch. : Fr.) Corner | 26/10/17 & 08/11/17 |
| Cordyceps militaris (Linnaeus ex Fries) Link | 08/11/17 |
| Cuphophyllus cereopallidus (Clémençon) Bon | 26/10/17 & 08/11/17 |
| Cuphophyllus niveus (Scop. ? Fr.) Bon | 26/10/17 |
| Cuphophyllus pratensis (Pers. : Fr.) Bon | 26/10/17 & 08/11/17 |
| Entoloma chalybaeum (Pers. : Fr.) Zerov ex Noordeloos | 26/10/17 |
| Entoloma hirtipes (Schum. : Fr.) Moser | 07/01/18 |
| Entoloma lanicum (Romagnesi) Noordeloos | 26/10/17 |
| Entoloma longistriatum (Peck) Noordeloos | 26/10/17 |
| Entoloma serrulatum (Fr. : Fr.) Hesler | 26/10/17 |
| Galerina perplexa A.H. Smith | 08/11/17 & 08/11/17 |
| Geoglossum cookeianum Nannfeldt | 26/10/17 & 08/11/17 |
| Hygrocybe ceracea (Wulfen : Fr.) Kummer | 07/01/18 |
| Hygrocybe chlorophana (Fr. : Fr.) Wünsche | 26/10/17 & 08/11/17 |
| Hygrocybe flavipes (Britzelmayr) Arnolds | 26/10/17 |
| Hygrocybe punicea (Fr. : Fr.) Kummer | 07/01/18 & 08/11/17 |
| Hygrocybe reidii Kühner | 26/10/17 & 08/11/17 |
| Hygrocybe splendidissima (P.D. Orton) Moser | 08/11/17 |
| Hygrocybe unguinosa (Fr. : Fr.) P. Karsten | 26/10/17 |
| Infundibulicybe gibba (Pers. : Fr.) Harmaja | 08/11/17 |
| Rickenella swartzii (Fr. : Fr.) Kuyper | 26/10/17 & 08/11/17 |
| Xerocomus rubellus Quélet | 26/10/17 |
Photos des espèces

Clavulinopsis corniculata 
Cuphophyllus niveus 
Cuphophyllus pratensis 
Dermoloma cuneifolium 
Entoloma longistriatum 
Entoloma plebejum 
Entoloma serrulatum 
Galerina perplexa 
Geoglossum cookeianum 
Hygrocybe cereopallida 
Hygrocybe chlorophana 
Hygrocybe flavipes 
Hygrocybe punicea 
Hygrocybe reidii 
Hygrocybe splendidissima 
Infundibulicybe gibba 
Rickenella swartzii 
Xerocomus rubellus
Application du protocole CHEGD
. Présentation du protocole
Le protocole de suivi standardisé CHEGD vise l’étude des champignons des pelouses et prairies maigres, tels que sont les Clavaires, les Hygrocybes, les Entolomes, les Géoglosses et les Dermolomes. Ces espèces sont typiques des anciennes prairies naturelles non perturbées mécaniquement et non amendées par des intrants chimiques (azote, phosphore, etc.), ce sont des champignons bioindicateurs. Au delà de l’acquisition d’une meilleur compréhension de l’évolution naturelle du site et de ses perturbations, l’application de ce protocole permet de révéler la valeur patrimoniale du milieu dans lequel vivent ces espèces. Il apporte aussi un éclairage sur l’état de conservation des habitats, l’historique, l’équilibre biologique et la maturité des sols.
. Indice de représentativité du site
Avant d’exploiter les données et de tenter de confronter les listes d’espèces obtenues aux différents indices, le protocole affirme qu’il est primordial de s’assurer que les données récoltées soient suffisantes et représentatives du cortège fongique de la prairie. En effet, les espèces rencontrées une seule fois au cours de la période d’étude peuvent être des taxons rares ou d’apparition sporadique mais un nombre important d’espèces vues une seule fois peut signifier un nombre de relevés trop faible par rapport à la diversité fongique du site.
La formule de l’indice est la suivante :
Indice de représentativité = 1 – nombre d’espèces vues 1x / nombre total d’espèces
Pour la prairie de Courcy, voici le calcul de l’indice :
Indice de représentativité = 1 – 13/23 = 0,43
L’interprétation de cet indice se traduit ensuite par les valeurs du tableau suivantes :
| Indice de représentativité (Ir) | Évaluation de l’échantillonnage |
| Ir ≤ 0,30 | Non significatif |
| 0,31 ≤ Ir ≤ 0,40 | Insuffisant |
| 0,41 ≤ Ir ≤ 0,60 | Représentatif |
| Ir ≥ 0,60 | Exhaustif |
Cette étude se base donc sur un échantillonnage tout juste représentatif.
. Les composantes CHEGD
Répartition des espèces par groupes :
C (clavaires)
| Clavaria fumosa Pers. : Fr. |
| Clavulinopsis corniculata (J.C. Sch. : Fr.) Corner |
H (hygrocybes)
| Hygrocybe ceracea (Wulfen : Fr.) Kummer |
| Hygrocybe chlorophana (Fr. : Fr.) Wünsche |
| Hygrocybe flavipes (Britzelmayr) Arnolds |
| Hygrocybe punicea (Fr. : Fr.) Kummer |
| Hygrocybe reidii Kühner |
| Hygrocybe splendidissima (P.D. Orton) Moser |
| Hygrocybe unguinosa (Fr. : Fr.) P. Karsten |
| Cuphophyllus cereopallidus (Clémençon) Bon |
| Cuphophyllus niveus (Scop. ? Fr.) Bon |
| Cuphophyllus pratensis (Pers. : Fr.) Bon |
E (entolomes)
| Entoloma chalybaeum (Pers. : Fr.) Zerov ex Noordeloos |
| Entoloma hirtipes (Schum. : Fr.) Moser |
| Entoloma lanicum (Romagnesi) Noordeloos |
| Entoloma longistriatum (Peck) Noordeloos |
| Entoloma serrulatum (Fr. : Fr.) Hesler |
G (géoglosses)
| Geoglossum cookeianum Nannfeldt |
D (dermolomes)
| Dermoloma cuneifolium (Fr. : Fr.) Singer ex Bon |
En toute logique et suivant la convention présentée dans le protocole, nous pouvons donc présenter l’ensemble des composantes CHEGD sous la forme :
C2 H10 E5 G1 D1
. Le gradient CHEGD
Le gradient CHEGD correspond au nombre total d’espèces concernées tous groupes confondus, soit pour le site étudié : 2 + 10 + 5 + 1 + 1 = 19.
Le gradient de la pelouse de Courcy est donc de 19. Ce gradient est un des paramêtres utiles et intéressants à mettre en avant lors de la comparaison avec d’autres sites naturelles.
. L’intérêt du site pour chaque groupe
L’intérêt du site est traduit par l’évaluation exlusive des CHEGD selon ce tableau :
| Taxons | Intérêt du site (nombre d’espèces) | ||||
| Faible | Local | Régional | National | International | |
| Clavaria, Clavulinopsis, Ramariopsis | 1 ou 2 | 3 à 4 | 5 à 8 | 9 et plus | |
| Hygrocybe, Cuphophyllus | 1 à 4 | 5 à 9 | 10 à 20 | 21 à 24 | 25 et plus |
| Entoloma | 1 à 3 | 4 à 7 | 8 à 16 | 17 à 19 | 20 et plus |
| Geoglossum, Microglossum, Trichoglossum | 1 | 2 | 3 | 4 et plus | |
| Dermoloma, Porpoloma | 0 | 1 | 2 | 3 et plus | |
Tableau 1 : Interprétation des relevés CHEGD (Bull. Soc. Mycol. Fr.)
Le résultat est donc :
Au regard des Clavaria, Clavulinopsis et Ramariopsis : intérêt faible
Au regard des Hygrocybe et Cuphophyllus : intérêt régional
Au regard des Entoloma : intérêt local
Au regard des Geoglossaceae : intérêt faible
Au regard des Dermoloma, Porpoloma et Camarophyllopsis : intérêt local
L’intérêt du site étant déterminé par le groupe dont la valeur est la plus haute, on parle ici d’un site d’intérêt régional sur le plan patrimonial.
Résultat
Seulement trois prospections sur la pelouse de Courcy ont permis d’inventorier 23 espèces. Ce résultat n’est pas négligeable et vu la beauté, la fragilité et la rareté des espèces observées, ce site méritait bien d’être analysé sur le plan patrimonial grâce au protocole CHEGD.
Cependant d’après le calcul de l’indice de représentativité, cet inventaire se base sur un échantillonage tout juste représentatif. Le résultat n’est donc pas exhaustif et nécessite d’autres inventaires. Malgré cela, l’intérêt patrimonial de cette pelouse atteint tout de même le niveau régional.
Conclusion et perspectives
Sans l’indice de réprésentativité, nous pourrions hâtivement et définitivement statuer sur un niveau patrimonial régional au regard des 10 espèces observées dans le groupe des Hygrocybe et Cuphophyllus. Mais cela serait aussi faire abstraction de la présence d’Hygrocybe punicea qui nécessite la présence d’au moins 8 espèces d’hygrocybes, alors que 7 seulement ont été observés.
Cette étude n’est donc pas exhaustive et nécessite d’être prolongée sur plusieurs années. Chose qui sera faite puisqu’au delà de l’émerveillement que procure la découverte de ces magnifiques champignons, le site en lui-même mérite toutes nos attentions. Aussi petite qu’elle soit, cette pelouse est à mes yeux une réserve naturelle de diversité biologique à protéger impérativement.
Bibliographie
Bon M.,2004. Champignons de France et d’Europe occidentale – Éditions Flammarion, 368 pages.
Bon M., 1992. Clé monographique des espèces Galero-Naucoroïdes – Documents Mycologiques Tome XXI, Fascicule 84. Lille. 89 pages.
Corfixen P. & Als., 1997. Heterobadidoid, Aphyllophoroid and Gastromycetoid Basidiomycètes – Nordic Macromycetes Vol. III – Nordsvamp Copenhagen, 445 pages.
Courtecuisse, R. 2009. Référentiel taxonomique des Basidiomycètes de France métropolitaine – Société Mycologique de France & ONF (format numérique).
Courtecuisse R. & Duhem B.,1994. Champignons de France et d’Europe – Les guides du naturaliste – Éditions delachaux et niestlé, Lausanne. 543 pages.
Eyssartier G. & Roux P.,2011. Le guide des champignons de France et d’Europe – Éditions Belin. 1119 pages.
Jülich W., 1982. Guida alla determinazione dei funghi Apphyllophorales, Hétérobasidiomycètes et Gastéromycètes – Éditions Saturnia, Trento. Vol 2., 597 pages.
Noordeloos M. E., 1992 & 2004. Entoloma s.l. – Fungi Europaei n°5 & n°5a – Éditions Candusso, Saronno. 1377 pages.
Raillere M., Gannaz M., 1999. Les Ramaria Européennes – Éditions F.M.D.S., 176 pages.
Laisser un commentaire